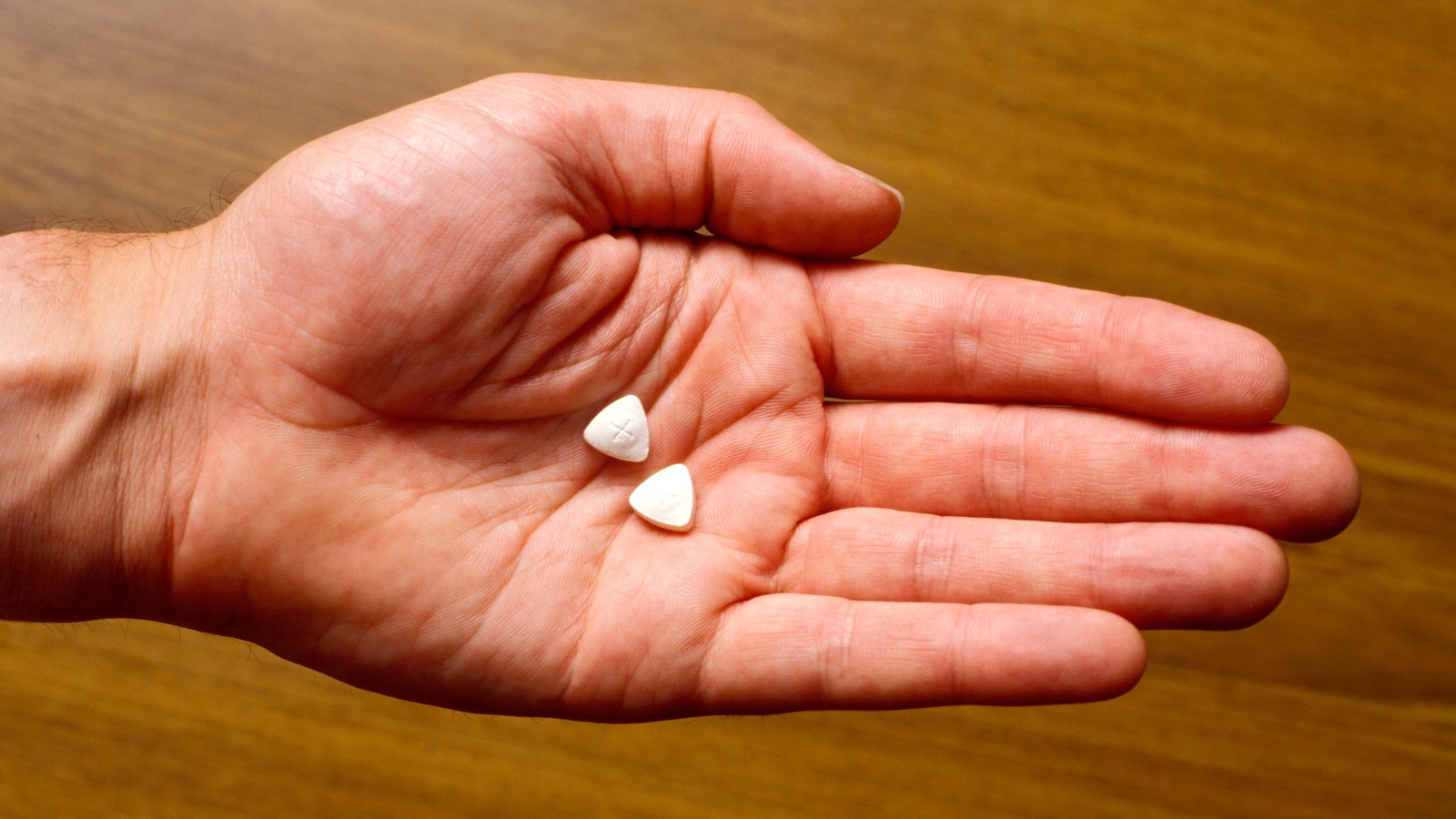
Badan Pengawas Obat dan Makanan (FDA) Amerika Serikat telah memutuskan untuk tidak menyetujui pengobatan psikedelik – beserta terapi – untuk mengobati gangguan stres pasca-trauma (PTSD), menurut Lykos Therapeutics, perusahaan yang mengajukan persetujuan. Pengobatan tersebut adalah versi farmasi dari midomafetamin, yang lebih dikenal sebagai MDMA dan terkadang disebut sebagai ecstasy. FDA meminta uji coba Tahap 3 tambahan. Penolakan ini datang setelah kontroversi tentang uji klinis Lykos yang ada, yang dirundung tuduhan pelanggaran. Isu-isu yang dipunculkan oleh FDA mencerminkan kekhawatiran serupa yang diungkapkan dalam pertemuan penasihat FDA pada bulan Mei, yang memberikan suara menolak persetujuan. Perusahaan mengatakan telah melakukan dua uji placebo acak tahap akhir untuk mengevaluasi keamanan dan efektivitas MDMA saat digunakan dalam kombinasi dengan intervensi psikologis, seperti terapi bicara, dan menemukan manfaatnya. Sejumlah studi telah menyiratkan bahwa obat psikoaktif, termasuk ganja, ketamin, jamur ajaib, dan MDMA, dapat membantu mengobati PTSD dan gangguan kesehatan mental lainnya. Beberapa psikiater mulai menggunakan MDMA untuk pengobatan pada akhir tahun 1970-an dan awal 1980-an, percaya bahwa hal tersebut membantu mempromosikan kepercayaan dan meningkatkan komunikasi antara dokter dan pasien. MDMA diklasifikasikan sebagai obat Jenis I, yang berarti memiliki “tidak ada penggunaan medis yang diterima saat ini dan potensi penyalahgunaan yang tinggi,” oleh Administrasi Penegakan Narkotika pada tahun 1985. FDA memiliki waktu hingga 11 Agustus untuk membuat keputusan tentang persetujuan. Keputusan FDA ini datang setelah sekelompok penasihat independen untuk lembaga federal itu memberikan suara menolak merekomendasikan persetujuan pengobatan selama pertemuan pada awal Juni. Komite Penasehat Obat Psikofarmaka tampaknya memiliki keraguan serius tentang keamanan dan efektivitas pengobatan. Di dokumen pendekatan yang dirilis di awal tahun ini, FDA mengatakan bahwa berdasarkan data uji klinis yang diajukan oleh Lykos Therapeutics, “peserta tampaknya mengalami perbaikan PTSD yang cepat, berarti secara klinis, dan tahan lama.” Meskipun ada keprihatinan dari pejabat kesehatan, para anggota DPR mendorong FDA untuk menyetujui pengajuan tersebut, dengan lebih dari 60 anggota Kongres menandatangani surat kepada Presiden Joe Biden menyatakan keinginan mereka agar FDA menyetujui pengobatan tersebut. Penolakan FDA terhadap aplikasi ini “tidak selalu berarti akhir dari pengembangan obat psikedelik, karena sejumlah isu yang menjadi perhatian tentang aplikasi ini terkait dengan fakta bahwa upaya untuk mendapatkan persetujuan MDMA hingga saat…
ABC News’ Dr. Nicholas Nissen berkontribusi dalam laporan ini.